华大在线讯(通讯员 周汉鸣)4月4日,立博体育app官网化学学院肖文精教授团队在国际顶级期刊《自然催化》(Nature Catalysis)发表题为"催化的金属偶极体接力实现对映选择性大环化"(Enantioselective macrocyclization via catalytic metallic dipole relay)的研究论文。该研究创新性地提出了"金属偶极体接力"策略,为轴手性大环化合物的高效合成开辟了新路径。立博体育app官网博士研究生曲宝乐(实验研究)和肖萌(理论计算)为共同第一作者,陆良秋教授和张之涵教授为共同通讯作者,立博体育app官网为第一完成单位。

手性大环化合物作为药物和功能材料的关键结构单元,其合成一直是有机化学领域的重大挑战。以"人类抗生素最后防线"万古霉素为例,其核心结构正是由轴手性联芳基单元与大环内酯构成。传统合成方法普遍面临环化效率低、手性控制难等瓶颈问题,严重制约了这类化合物的开发应用。
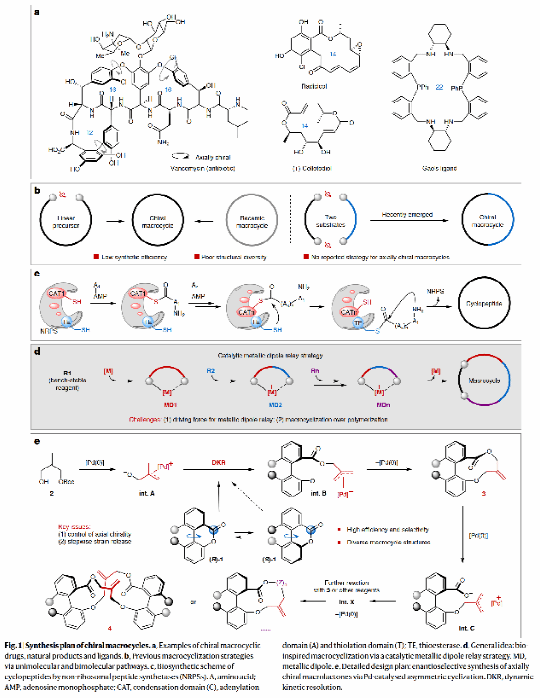
针对这些挑战,研究团队从非核糖体环肽的生物合成机制获得灵感,独辟蹊径,首次提出"π-烯丙基钯偶极体接力"的新思路,通过动态动力学拆分与不对称偶极环化的协同作用,成功实现了两类14元、一类15元和一类20元轴手性大环内酯的高效构筑。具体而言,研究团队首先优化了关键中间体手性10元环内酯的合成条件,发现带氢键给体的手性双膦配体能够在温和条件下获得83%的分离收率和90%的对映选择性(ee)。在此基础上,研究了该催化体系在不对称[6+4]环化反应中的普适性,并成功实现了分步的[6+4]和[10+10]串联环化反应,高选择性地构建了轴手性的20元大环内酯化合物(高达>99% ee)。在动力学实验与DFT计算等机理研究的基础上,研究团队提出了截断(10+10)偶极环化、发展(10+x)偶极环化的设想,成功实现了轴手性10元环内酯与氮杂二烯、α-重氮酮以及乙烯基环丙烷的一系列不对称(10+4)(10+2+2)和(10+5)偶极环化反应,合成了结构多样的14元和15元轴手性大环内酯化合物。甚至从最初的联芳基6元环内酯出发,实现一步或一锅的不对称(6+4)/(10+x)串联环化反应,显著提升了上述4类轴手性大环内酯的合成效率。研究团队通过理论计算,成功揭示了联芳基二面角及内酯键与芳基二面角的变化规律,证明了联芳基扭转张力的逐步释放是成功的关键。
该研究发展的"金属偶极体中继策略"不仅显著提升了手性大环内酯的合成效率,还兼具产物结构多样、官能团兼容性好、立体选择性高的优势,为手性大环化合物的不对称催化合成提供了全新思路。
陆良秋教授长期致力于手性杂环不对称合成研究。针对杂环合成领域长期存在的环系大小与立体选择性控制难题,系统性地开展了金属催化的不对称偶极环化反应研究,为开发抗癌活性分子和肿瘤细胞成像功能分子提供了重要平台和工具,近期在《美国化学会志》(J. Am. Chem. Soc. 2025, 147, 3223; 2024, 146, 26622-26629; 2022, 144, 19932-19941)和《德国应用化学》(Angew. Chem. Int. Ed. 2024, 63, e202319728; 2024, 63, e202408426; 2023, 62, e202301592; 2023, 62, e202212444; 2022, 61, e202117215)等顶级化学专业期刊上发表多篇研究论文。相关研究工作长期得到国家自然科学基金委、湖北省科技厅、立博体育app官网、武汉光化学技术研究院、河南师范大学和中国科学院兰州化学物理研究所等机构的经费支持。
论文链接:https://www.nature.com/articles/s41929-025-01322-9
(审读人:郭彦炳 段治国)